Alótropos del Fosforo
6/26/20253 min read


El fósforo es el elemento número 15 de la tabla periódica. En la naturaleza no se encuentra en su estado puro ya que se trata de un material muy reactivo. En cuanto a su forma pura se puede encontrar de diversas maneras, posee diversos alótropos.
Un alótropo es una de las maneras en las que puede disponerse la estructura cristalina de un compuesto. Como por ejemplo el carbono, el diamante, el grafito, NTC, entre otros están formados por solo carbono sin embargo la manera en la que se ordenan es lo que los vuelve tan diferentes. Por supuesto esta propiedad no es exclusiva del carbono existen un montón de sustancias polimorfas, entre ellas el fosforo.
Fosforo Blanco
Es la forma básica del fosforo y de la cual derivan todas las demás
Es altamente inestable, entrando en ignición a tan solo 30 grados
Existe en forma de molécula que consta de 4 átomos de fosforo (P4) en una estructura tetraédrica
Aún así bajo diversas condiciones se puede cristalizar en forma hexagonal o cúbica centrada en las caras.
Es muy tóxico
Este elemento se descubrió durante la época de la alquimia. En la búsqueda de la piedra filosofal, el alquímico Brand empezó a estudiar la orina (inspirado por su color dorado) y aunque no consiguió oro si consiguió aislar por primera vez el fosforo
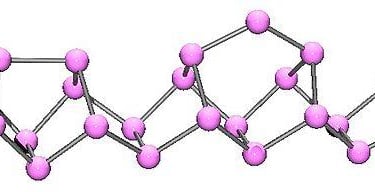
Fosforo Rojo
Es el fosforo que todos conocemos, es lo que nos encontramos en las cabezas de las cerillas.
Se trata de una sustancia amorfa y de color rojizo
Es poco soluble en agua u otros disolventes orgánicos
Es mas estable que el fosforo blanco y solo entra en ignición a mas de 240 grados
Se obtiene al exponer fosforo blanco a la luz solar o al calentarlo a 250 grados
No presenta una estructura química definida sino que es una estructura polimérica amorfa
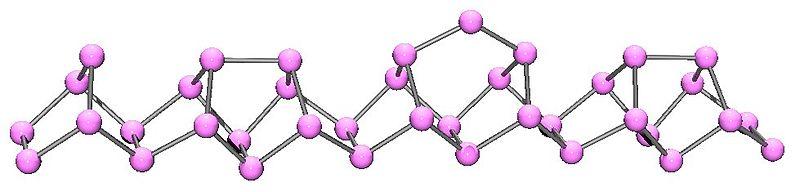
Fosforo Violeta
Es obtenido a partir del fosforo rojo, al calentarlo por un periodo muy largo de tiempo, Otra manera es disolver el fosforo blanco en plomo fundido a altas temperaturas y luego someterlo a un periodo de congelamiento lento. De ambas maneras, el fosforo cristaliza adquiriendo este color
También es llamado fosforo de Hittorf por su descubridor.
Al igual que el fosforo rojo, es muy insoluble
Este es incluso más estable que el rojo ya que, no entra en ignición en aire a menos que sea calentado a 300°C
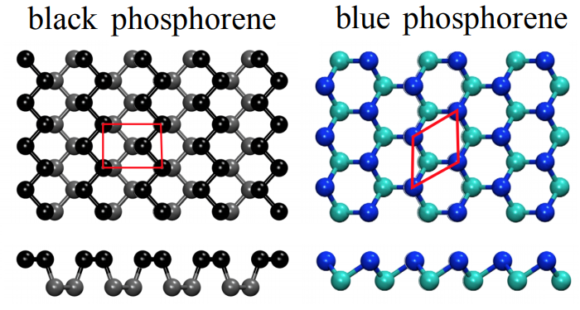
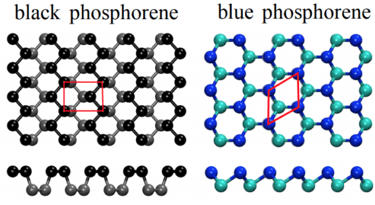
Fosforo negro
Se obtiene al calentar fósforo blanco a 12.000 atmosferas.
Es estable a condiciones normales y termodinámicamente hablando el más estable de los alótropos ()
Tiene una estructura similar a la del grafito, lo que le otorga propiedades parecidas.
Es de color negro
Buena conductividad eléctrica
Al igual que el grafito se puede laminar para obtener grafeno, este se puede laminar para obtener fosforeno
Gracias a esto se estudia para posibles usos en nanotecnología
Fosforo azul
El último de los descubiertos, es una forma cristalina del fósforo, termodinámicamente más estable que el fósforo negro a presión ambiente, aunque más difícil de obtener. Se predijo teóricamente en 2014 y luego fue sintetizado en condiciones específicas.
Se puede obtener mediante conversión láser o térmica del fósforo negro, o por crecimiento en una lámina metálica de oro
Tiene una estructura en capas, similar al fósforo negro pero con una configuración más simétrica.
Cada capa forma una red tipo panal como en el grafeno, pero con átomos de fósforo en una estructura corrugada
Se comporta como un semiconductor, lo que es un alótropo muy nuevo por lo que todavía se esta estudiando posibles aplicaciones
Como es una estructura en capas a lo mejor os preguntáis si se puede laminar para obtener una estructura similar al grafeno. Teóricamente es así pero al ser un material menos accesible y más difícil de sintetizar en volumen, su exfoliación no está tan estandarizada como en el caso del fósforo negro o el grafito.
En algunos trabajos, se ha logrado exfoliar monoláminas de fósforo azul usando técnicas similares a las del grafeno, pero los rendimientos son bajos y difíciles de estudiar