Dentro del átomo: Cómo descubrimos que lo "indivisible" tenía partes
FÍSICAQUÍMICA
11/15/202510 min read
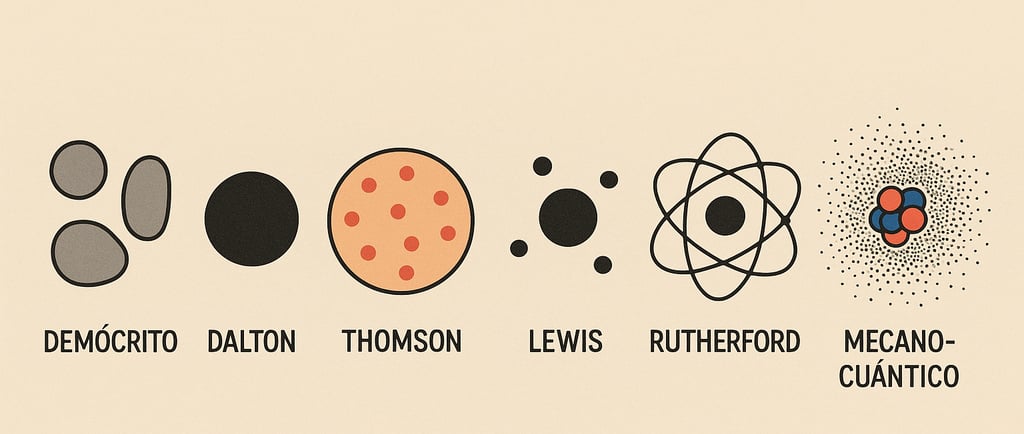
En 1808, John Dalton proclamó triunfante que había encontrado los átomos de Demócrito: el hidrógeno, el carbono, el oxígeno... las partículas fundamentales e indivisibles de la materia. Durante casi un siglo, los científicos creyeron que finalmente habían llegado al fondo, que habían encontrado los bloques básicos de construcción del universo.
Estaban completamente equivocados.
En solo 35 años vertiginosos —desde 1897 hasta 1932— tres descubrimientos demolerían la idea del átomo indivisible y revelarían que esos "átomos" eran en realidad pequeños universos con su propia estructura interna compleja. Esta es la historia de cómo descubrimos el electrón, el protón y el neutrón, y cómo el átomo de Dalton se convirtió en algo mucho más fascinante.
1897: El electrón
Joseph John Thomson (1856-1940) comenzó su carrera como físico matemático, lo cual hace aún más irónico que se sorprendiera cuando en 1884 fue nombrado profesor de física experimental del famoso Laboratorio Cavendish de la Universidad de Cambridge. No era exactamente el currículum ideal para trabajar con equipos de laboratorio.
Pero Thomson tenía algo más valioso que destreza manual: curiosidad implacable y rigor matemático.
Para 1896, los físicos llevaban décadas intrigados por un fenómeno extraño: los rayos catódicos. Cuando se aplicaba alto voltaje a través de un tubo de vidrio con gas a baja presión, emanaba del cátodo (electrodo negativo) una misteriosa radiación que viajaba hacia el ánodo (electrodo positivo) y hacía brillar las paredes del tubo con un resplandor fantasmal.
¿Pero qué eran exactamente estos rayos? ¿Ondas electromagnéticas como la luz? ¿Moléculas de gas cargadas? Nadie lo sabía con certeza.
Ya en 1874, el físico irlandés George Johnstone Stoney había acuñado la palabra "electrón" para referirse a la unidad de electricidad que se pierde cuando un átomo se convierte en un ion. Pero esto era pura teoría derivada de las leyes de Faraday sobre electrólisis. Nadie había visto ni medido un electrón.
El experimento que cambió todo
En 1896, Thomson se propuso resolver el misterio. Construyó un tubo de vidrio de unos 40 centímetros de largo con un diseño ingenioso:
En un extremo, el cátodo emitía sus rayos misteriosos
Los rayos pasaban a través de un agujero en el ánodo
Golpeaban una pantalla fluorescente, produciendo una pequeña mancha verde
Entre el ánodo y la pantalla, Thomson insertó dos placas metálicas conectadas a una batería
Las placas creaban un campo eléctrico perpendicular al rayo catódico. La idea era simple pero brillante: si los rayos llevaban carga eléctrica, el campo los desviaría. Si eran fotones (partículas de luz), seguirían su camino en línea recta ignorando las placas.
Thomson encendió el equipo y observó. La mancha verde se movió.
Cuando la placa superior era negativa, la mancha se desviaba hacia abajo. Cuando era positiva, la mancha subía. Los rayos catódicos estaban definitivamente cargados, y negativamente.
Pero Thomson no se conformó con saber que los rayos estaban cargados. Mediante una ingeniosa combinación de campos eléctricos y magnéticos, logró medir e/m: la razón entre la carga eléctrica del rayo y su masa.
Luego vino la parte más importante del experimento: la verificación sistemática. Thomson cambió el material del cátodo —aluminio, platino, cobre, latón— y repitió el experimento. Siempre salía el mismo número. Cambió el gas del tubo: aire, hidrógeno, dióxido de carbono. El mismo resultado.
La conclusión era inevitable: los rayos catódicos no eran moléculas de gas cargadas (que variarían según el material), sino partículas fundamentales universales que formaban parte de toda materia.
La medición de la carga del electrón
Para obtener la masa real del electrón, Thomson necesitaba medir la carga eléctrica e por separado. Utilizó la cámara de niebla, inventada por su alumno el escocés C.T.R. Wilson para estudiar las propiedades de la lluvia (recurso no escaso en Escocia).
La cámara funcionaba así: cuando el vapor de agua se condensa, normalmente lo hace sobre partículas de polvo. Pero cuando el aire está limpio, los iones cargados eléctricamente pueden desempeñar el papel del polvo, formando gotitas visibles. Thomson medía la carga total de la cámara y determinaba la carga individual contando las gotitas y dividiendo.
Con esto obtuvo el valor correcto de e y finalmente pudo calcular la masa del electrón.
En 1898, Thomson hizo un anuncio que sacudió los cimientos de la física:
"Los electrones son componentes del átomo. Los rayos catódicos son electrones que han sido separados del átomo."
La reacción de la comunidad científica fue de shock. Durante un siglo habían creído que el átomo químico era el á-tomo indivisible de Demócrito. Thomson decía ahora que el resplandor de su tubo probaba que había un ingrediente universal, un constituyente menor de todos los átomos químicos.
Thomson había hecho trizas el átomo indivisible.
El electrón: Más extraño de lo que imaginamos
Hoy sabemos que el electrón es una de las partículas más extrañas del universo. Es un punto matemático sin dimensiones —en 1990 se midió que su radio es menor que 10⁻¹⁸ centímetros, esencialmente cero— pero de alguna manera tiene masa y carga eléctrica.
Tiene una propiedad llamada espín (aunque no gira literalmente como una peonza), y genera un campo magnético. Y gracias al principio de incertidumbre de Heisenberg (1927), es fundamentalmente imposible medir simultáneamente su posición y velocidad con precisión arbitraria. No es una limitación tecnológica; es una ley fundamental de la naturaleza.
Y sin embargo, toda nuestra civilización tecnológica —electricidad, electrónica, computadoras, internet— se basa en este pequeño y misterioso compañero.
1911: El núcleo
Ernest Rutherford era un neozelandés de voz atronadora y personalidad arrolladora. Fue el primer estudiante extranjero admitido en el Laboratorio Cavendish, llegando justo a tiempo para presenciar el descubrimiento del electrón por Thomson.
Después de trabajar en la Universidad McGill de Montreal y regresar a Inglaterra para ocupar un puesto en Manchester, ganó el Premio Nobel en 1908 por sus trabajos sobre la radiactividad. Para casi cualquiera, esto habría sido el clímax de una carrera. Pero no para Rutherford.
Thomson había complicado enormemente el problema de la materia. El átomo ahora tenía electrones negativos revoloteando en su interior. Pero la materia es eléctricamente neutra. Entonces, ¿qué compensaba la carga negativa de los electrones?
El modelo dominante hacia 1905 era el propuesto por el propio Thomson: el "modelo del pudín de pasas". La carga positiva se distribuía uniformemente por toda una esfera del tamaño del átomo, con los electrones insertados en ella como pasas en un pudín.
Era un modelo razonable. Pero estaba completamente equivocado.
En 1909, Rutherford diseñó un experimento para investigar la estructura interna del átomo. Utilizó una fuente radiactiva que emitía naturalmente partículas alfa (que él mismo había descubierto que eran núcleos de helio) y las dirigió contra una lámina de oro extremadamente delgada.
El montaje era elegante:
Una fuente de radón-222 en un recipiente de plomo con un agujero estrecho
Las partículas alfa atravesaban la lámina de oro finísima
Una pantalla detectora registraba los ángulos de desviación
Según el modelo del pudín de pasas, las partículas alfa —masivas en comparación con los electrones— deberían atravesar el átomo con desviaciones mínimas, como balas atravesando niebla.
El resultado que dejó atónito a Rutherford
Los resultados iniciales parecían confirmar las expectativas. La mayoría de las partículas alfa atravesaban la lámina sin apenas desviarse. Pero entonces apareció algo completamente inesperado:
Una de cada 8.000 partículas alfa rebotaba hacia atrás.
Como el propio Rutherford exclamó con su característico dramatismo:
"Era como si disparases un obús de artillería de 15 pulgadas contra papel de seda y la bala rebotase y te diera."
Esto era imposible según el modelo de Thomson. Si la carga positiva estaba distribuida uniformemente por todo el átomo, ninguna concentración de carga podría ser lo bastante fuerte para hacer rebotar una partícula alfa masiva y rápida.
El momento eureka
Durante casi dos años, Rutherford y su equipo recopilaron datos meticulosamente. Entonces, a principios de 1911, Rutherford tuvo su momento de iluminación. Saludó a sus alumnos con una amplia sonrisa:
"Sé a qué se parecen los átomos y entiendo por qué se da la fuerte dispersión hacia atrás."
Su conclusión era radical: la única configuración capaz de hacer que una partícula alfa retroceda era que toda la masa y la carga positiva se concentren en un volumen minúsculo en el centro del átomo. ¡El núcleo!
Los electrones estarían distribuidos en una enorme esfera alrededor de ese núcleo diminuto. Con datos mejores, la teoría se refinó: el núcleo ocupa no más de una billonésima parte del volumen del átomo.
Esta revelación era filosóficamente alucinante. Según el modelo de Rutherford, la materia es, más que nada, espacio vacío.
Cuando tocas una mesa, la percibes sólida. Pero en realidad es el juego entre las fuerzas eléctricas (y las reglas cuánticas) de los átomos y moléculas lo que crea la ilusión de solidez. Si pudieras eliminar todo el espacio vacío de los átomos de tu cuerpo, cabrías en un grano de arena microscópico.
El átomo de Rutherford era como un sistema solar en miniatura: un "sol" denso y masivo (el núcleo) con "planetas" (electrones) orbitando a distancias enormes en comparación con sus tamaños.
Bohr completa el cuadro
En 1913, el físico danés Niels Bohr refinó el modelo de Rutherford incorporando las nuevas ideas de la mecánica cuántica. Propuso que los electrones solo pueden ocupar órbitas específicas con energías definidas, y que saltan entre estas órbitas emitiendo o absorbiendo luz de frecuencias específicas.
Este modelo explicaba finalmente las líneas espectrales —las "huellas dactilares" de luz que emite cada elemento— que habían desconcertado a los científicos durante décadas.
1932: El neutrón - La pieza que faltaba
Para 1920, los físicos tenían un nuevo rompecabezas. Se conocía el electrón que rodeaba el núcleo. Se conocía que el núcleo contenía protones —partículas con carga positiva— porque la radiactividad los liberaba.
Pero había un problema grave: si el núcleo solo contenía protones, ¿por qué no explotaba? Las cargas positivas se repelen violentamente. ¿Qué mantenía unido al núcleo?
Además, había inconsistencias matemáticas. Los valores de espín medidos experimentalmente en los núcleos no concordaban con los que se deducían si el núcleo solo contenía protones y electrones. Algo faltaba.
En 1920, Ernest Rutherford hizo una predicción audaz: debía existir una partícula en el núcleo con masa similar al protón pero sin carga eléctrica. Esta partícula neutra podría:
Estabilizar el núcleo al separar los protones
Explicar por qué la masa de los núcleos era mayor que la suma de sus protones
Resolver las inconsistencias del espín nuclear
Rutherford llamó a esta partícula hipotética el "neutrón".
James Chadwick, alumno de Rutherford, pasó más de una década buscando esta partícula esquiva. El problema era obvio: si no tiene carga eléctrica, ¿cómo detectarla? No deja trazas en detectores, no se desvía por campos eléctricos o magnéticos, es prácticamente invisible.
A finales de 1932, Chadwick realizó una serie de experimentos bombardeando berilio con partículas alfa. La radiación resultante tenía propiedades extrañas que no concordaban con las predicciones físicas:
La energía producida era muy superior a la esperada
En las colisiones no se conservaba el momento
Chadwick se enfrentó a dos opciones:
Aceptar que el momento no se conserva en las colisiones (lo que contradecía las leyes fundamentales de la física)
Aceptar que la radiación consistía en partículas sin carga
Como buen científico, optó por la segunda hipótesis. Los cálculos mostraban que estas partículas tenían una masa muy similar a la del protón, pero sin carga eléctrica.
El neutrón había sido descubierto.
El descubrimiento era tan importante que le valió a Chadwick el Premio Nobel de Física en 1935, solo tres años después. Récord de velocidad para el comité Nobel, normalmente más cauteloso.
Con el neutrón, finalmente se completó el cuadro básico del átomo:
Electrones: Negativos, orbitan el núcleo, casi sin masa
Protones: Positivos, en el núcleo, 1836 veces más pesados que el electrón
Neutrones: Neutros, en el núcleo, masa similar al protón
El átomo revelado
En solo 35 años —desde el electrón de Thomson en 1897 hasta el neutrón de Chadwick en 1932— el átomo "indivisible" de Dalton se había transformado en un sistema de complejidad asombrosa:
La arquitectura atómica
El núcleo (descubierto por Rutherford, 1911):
Ocupa el centro del átomo
Contiene el 99.9% de la masa
Ocupa solo una billonésima parte del volumen
Compuesto de protones y neutrones unidos por la fuerza nuclear fuerte
Los electrones (descubiertos por Thomson, 1897):
Orbitan el núcleo en niveles cuánticos específicos
Determinan las propiedades químicas del elemento
Ocupan casi todo el volumen del átomo
Son puntos matemáticos sin dimensiones
Escalas que desafían la intuición
Para apreciar las escalas involucradas, imagina esto:
Si el núcleo fuera del tamaño de una pelota de tenis (7 cm), el átomo completo sería una esfera de 7 kilómetros de diámetro
Si ampliaras un átomo hasta el tamaño de un estadio de fútbol, el núcleo sería más pequeño que una arveja en el centro del campo
Un electrón, a esa escala, sería completamente invisible, un punto matemático sin tamaño
La ironía del nombre
Y así llegamos a la ironía final: lo que llamamos "átomos" —hidrógeno, carbono, oxígeno— no son átomos en el sentido de Demócrito. No son indivisibles. Son sistemas compuestos con estructura interna compleja.
Los químicos del siglo XIX corrieron demasiado al reclamar que habían encontrado los á-tomos fundamentales. Pero su "error" fue productivo: al establecer que la materia tiene estructura en niveles discretos, abrieron la puerta a un siglo de descubrimientos.
El legado: La base de todo lo que vino después
El descubrimiento de la estructura interna del átomo no fue solo un triunfo intelectual. Fue la base de:
La tabla periódica moderna: Ahora entendemos que los elementos se ordenan por número de protones
La química cuántica: Las propiedades químicas emergen de la configuración electrónica
La energía nuclear: La fisión y fusión manipulan el núcleo
La electrónica: Toda nuestra tecnología manipula electrones
La física de partículas: Nos llevó a descubrir que protones y neutrones tienen estructura interna (quarks)
En 1808, Dalton creyó haber llegado al final del camino. En 1932, Chadwick completó el modelo que explica la química y gran parte de la física. Pero el viaje estaba lejos de terminar.
Porque resultaría que los protones y neutrones también tienen partes. Y esas partes —los quarks— abrirían un mundo aún más extraño y maravilloso.
