Los Gases Nobles SI Reaccionan: Compuestos de los gases Nobles
QUÍMICA
7/27/20257 min read

Al final de la tabla periódica encontramos un grupo bastante tímido al que no le gusta tener contacto con ningún otro elemento, ni siquiera consigo mismos. Estos están conformados por el helio, neón, argón, kriptón, xenón y radón. la valencia de estos elementos es igual a cero. Los átomos de los gases inertes no son capaces de entregar ni aceptar electrones. se les concedió el título de "gases nobles”
Antiguamente se creía que los gases nobles no podían formar compuestos debido a su configuración electrónica en capas cerradas, lo que los hace muy estables químicamente y poco reactivos. Los electrones se van colocando en capas s, p, d y f; al llegar a los gases nobles, estas capas están completas. Los átomos buscan completar sus capas electrónicas, y en todos los gases nobles la última capa está completa (ns² np⁶), excepto en el helio, que no tiene capa p pero igualmente se considera completo (ns²).
Los químicos, establecieron que la capa exterior con ocho electrones es extraordinariamente estable que los átomos buscarían completar. El flúor buscaría ganar un electrón para completarla y el oxígeno 2, por su parte el sodio, litio o potasio buscarían deshacerse de un electrón para completarla. Los gases nobles no tienen ninguna razón para perder o ganar electrones.
Primeros intentos de hacerlos reaccionar
Sin embargo, en 1933 Linus Pauling predijo que los gases nobles más pesados podían formar compuestos con el flúor y el oxígeno, aunque predicciones posteriores sobre el XeF₈ indicaron que no sería estable termodinámicamente ni cinéticamente.
Aún así, Los químicos seguían confiando en la posibilidad de romper la obstinada resistencia de los gases inertes. Probaron de diversas formas. Los llevaron hasta temperaturas tan altas que cualquier metal se hubiese fundido, los enfriaban hasta volverlo sólido, probaron con descargas eléctricas, la acción de los reactivos químicos más fuertes, altas presiones pero Todo en vano
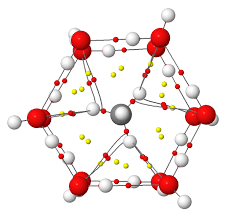
Los científicos lograron crear pequeñas trampas para intentar que reaccionasen. La primera fueron los clatratos (también conocidos como compuestos jaula), estructuras donde los gases nobles quedan atrapados dentro de cavidades en redes moleculares de sustancias orgánicas e inorgánicas. De esta manera, los químicos consiguieron encerrar los átomos de argón, kriptón y xenón dentro de jaulas químicas, aunque el helio y neón, al ser muy pequeños, se escapaban.
Otra estrategia fue disolverlos en agua comprimiendo los gases nobles. Se cree que la molécula de agua, que forma un dipolo fuerte, induce un dipolo débil en los átomos del gas noble, generando una interacción dipolo-dipolo. Este efecto afecta más a los átomos más pesados, aunque se debate si realmente llegaron a estar verdaderamente hidratados.
Sin embargo, estas no eran realmente reacciones químicas de gases nobles, sino solo formas de atraparlos físicamente.
Primeros Compuestos
Se estableció una estrategia en la que se atacaría primero a los gases nobles más pesados primero. Estos al tener la capas de electrones más alejada del núcleo hace que experimenten un efecto de apantallamiento mayor. La acción de los electrones internos debilita la atracción que recibe del núcleo por lo que puede entonces ser ionizado con mayor facilidad y que la nube electrónica esté menos compactada. Esto hace que la energía de ionización sea más baja a medida que el átomo crece. Cuanto más pesado es el gas inerte, tanto menor es la energía necesaria de ionización
El químico canadiense Neil Bartlett estudiaba hexafluoruro de platino, PtF₆. Los compuestos de flúor con metales pesados son sustancias muy interesantes y químicamente activas. Bartlett sometió el PtF₆ a la acción del oxígeno y obtuvo un compuesto notable. Este contenía oxígeno en forma de molécula positiva O₂⁺, es decir, una molécula que había perdido un electrón. Lo extraordinario de esto es que separar un electrón de la molécula de oxígeno requiere una gran energía. Sin embargo, el hexafluoruro de platino logró arrancar un electrón a la molécula de oxígeno, oxidando al propio oxígeno.
Como la energía de ionización del O₂ a O₂⁺ (1165 kJ mol⁻¹) es prácticamente igual a la energía de ionización de Xe a Xe⁺ (1170 kJ mol⁻¹), Bartlett dedujo que podría ser más fácil hacer que el átomo de xenón perdiera un electrón que la molécula de oxígeno. Entonces intentó la reacción de Xe con PtF₆, la cual produjo un producto cristalino: hexafluoroplatinato de xenón, cuya fórmula se propuso inicialmente como Xe⁺[PtF₆]⁻. Posteriormente se demostró que el compuesto es más complejo, conteniendo tanto XeFPtF₆ como XeFPt₂F₁₁. Este fue el primer compuesto real producido a partir de un gas noble. Los esfuerzos de Bartlett se coronaron con éxito: en 1962 se obtuvo el primer compuesto químico de un gas inerte en el mundo. Su fórmula es XePtF₆ y, además, es bastante estable. Así nació una nueva rama de la química: la química de los gases inertes.
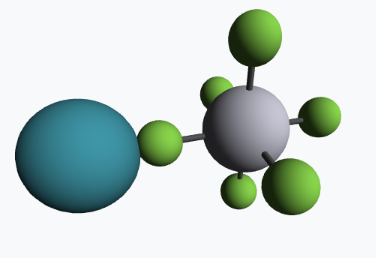
Posteriormente, en 1962, Howard Claassen sintetizó el primer compuesto simple (dos elementos) de un gas noble: el tetrafluoruro de xenón. Lo logró sometiendo una mezcla de xenón y flúor a altas temperaturas. Pronto se descubrieron muchos más fluoruros de xenón, kriptón y radón: XeF₂, XeF₄, XeF₆ y XeF₈. También surgieron compuestos con oxígeno como XeO₄ y XeO₂F₄. Lo sorprendente fue que, después de tantos intentos complejos para hacerlos reaccionar, al final resultó ser mucho más sencillo de lo esperado. El difluoruro de xenón, por ejemplo, se puede obtener simplemente exponiendo los gases de Xe y F₂ a la luz solar.
De distintos países llegaban noticias sobre la síntesis de nuevos compuestos químicos del kriptón, xenón y radón: xenón bi-, tetra- y hexavalente, kriptón tetravalente... La barrera parecía haberse roto con varios compuestos ya sintetizados, algunos incluso tan raros como un excímero. Un excímero (término proveniente de "dímero excitado") es un dímero de corta vida—el tiempo de vida de un excímero es del orden de los nanosegundos—como el Xe₂ muy inestable eso es verdad pero me sorprendió ver un compuesto de xenón dímero, aún así si hay compuestos estables.
La gama de compuestos es impresionante, ya que llega a los centenares e incluye enlaces de xenón con oxígeno, nitrógeno, carbono e incluso oro, se puede encontrar como ácido perxénico, haluros e iones complejos. El compuesto Xe₂Sb₂F₁₁ contiene un enlace Xe-Xe, el enlace elemento-elemento más largo que se conoce (308,71 pm).
Con los otros elementos
Así resulto ser para los más pesados, el xenon y kripton. Aunque también se espera que los gases nobles más ligeros neón, helio sean reactivos bajo condiciones adecuadas siguen siendo los dos últimos elementos de larga vida de la tabla periódica para los que no se conoce ningún compuesto estable.
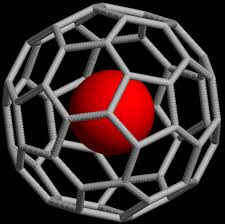
En el 2000 se sintetizo el primero estable para el argón. la fotólisis del fluoruro de hidrógeno en una matriz sólida de argón dio como resultado el fluorohidruro de argón (HArF). No es la primera sustancia con argón pero si cálculos indican que HArF puede ser la primera estable. Se ha logrado encapsularlos, Encapsulación de neón mediante un clatrato cristalino orgánico y tanto el helio como neón se han podido atrapar dentro de fullerenos. Pero otra vez no es un compuesto realmente.
El helio es sin dudas el más complicado de que reaccione:
La primera energía de ionización del helio , de 24,57 eV (2370.79Kj/mol) más del doble que para el xenón y la más alta de cualquier elemento.
Tiene una afinidad electrónica es de 0,080 eV, que es muy cercana a cero.
El átomo de helio es pequeño, con un radio de la capa electrónica externa de 0,29 Å. Es un átomo muy duro con una dureza de Pearson de 12,3 eV.
Las fuerzas repulsivas entre el helio y otros átomos pueden superarse mediante altas presiones. Lo más cerca es un compuesto cristalino descubierto en 2016 con sodio bajo presión. El heluro de disodio (Na₂He) requiere 1.130.000 atmósferas de presión para formarse. Para comparar, en el punto más bajo del océano, a 11 km de profundidad, solo hay 1.100 atmósferas.
Este compuesto realmente sería un electruro, un compuesto iónico donde los electrones actúan como aniones. Los átomos de helio no participan directamente en ningún enlace; sin embargo, los pares de electrones pueden considerarse como un enlace de dos electrones con ocho centros.
Existen otros compuestos de helio, como el helio-hidruro (HeH⁺), que se ha detectado en el espacio (en la nebulosa planetaria NGC 7027) y se ha obtenido en laboratorios bajo condiciones muy específicas. Otros ejemplos incluyen HeAuF, HeN₂⁺ y LiHe. Ninguno de estos compuestos es estable y todos requieren condiciones muy específicas de temperatura y presión.
Radón y Oganesón
En los átomos más grandes incluso que el xenón se esperaría que fuesen más reactivos pero son extremadamente radioactivos lo que dificulta cualquier estudio. El radón tiene vida media 3,8 días con el isótopo 222 Rn. Aún así se ha logrado sintetizar un fluoruro ( RnF 2 ) y su óxido ( RnO 3 ) con sus productos de reacción.
Todos los isótopos conocidos del oganesón tienen vidas medias aún más cortas, del orden de milisegundos, y teniendo en cuenta que solo se han podido hacer unas pocas unidades de átomos, no se conocen compuestos y muy poco acerca de su química. Se espera que sea incluso más reactivo que el radón, con una química más parecida a la de un elemento normal que a la de un gas noble e incluso puede que sea sólido.
