¿Por qué el mercurio es líquido a temperatura ambiente?
QUÍMICA
8/3/20255 min read
El mercurio es un metal fascinante que ha cautivado a la humanidad desde tiempos antiguos. Es ampliamente conocido por ser el único elemento metálico líquido en condiciones estándar, no es del todo cierto, si existen otras aleaciones que si se mantienen líquidas a temperatura ambiente, cosa a la que le dedicaré una entrada próximamente.
Si es el único metal elemental. El único otro elemento que es líquido bajo estas condiciones es el bromo (halógeno), aunque otros metales como el cesio, el galio, y el rubidio se funden a temperaturas ligeramente superiores y incluso podrías fundirlo con tu mano.
Antes de nada tengo que hacer una pequeña aclaración sobre la temperatura y el punto de fusión.
la temperatura de un objeto indica lo rápido que se mueven los átomos o las moléculas que lo componen. Átomos con mucha energía vibraran más deprisa e indicaría que esta caliente. Un objeto frío tiene átomos con menos energía y se moverán más despacio
Por otra parte la temperatura de fusión de un compuesto depende de la fuerza con la que están unidos sus átomos, es decir, la fuerza de enlace químico. Un enlace fuerte mantendrá la estructura rígida, los átomos tendrán menos libertad, estará más atado a la estructura y es lo que conocemos como un sólido. Si las fuerzas que mantienen los átomos unidos son muy débiles, no podrán retener a los átomos en la estructura y tendrán más movimiento. Eso será un líquido. Si seguimos aumentando la energía de los átomos (o moléculas) o con una energía de enlace muy baja, no interaccionarían entre si y tendríamos un gas
Al aumentar la temperatura aumentan las vibraciones de sus moléculas se vuelve cada vez más rápida. En el momento en que su energía supera a la del enlace estos no pueden retenerlo más y cambia de fase. Por tanto en resumen, a más fuerza de enlace la temperatura de fusión será mayor y mientras menor fuerza de enlace, menor temperatura será necesaria.
Para un metal nos encontramos con que están unidos por un enlace metálico. En este los electrones de valencia se deslocalizan en un "mar electrónico" alrededor de todos los cationes. Al empezar en una fila el enlace es débil ya que solo hay un electrón, al avanzar en la tabla periódica vamos añadiendo electrones, la fuerza del enlace va aumentando hasta llegar a un máximo, en el grupo del wolframio. Aquí empieza a bajar porque se llenan las bandas antienlazantes (Los electrones más que favorecer el enlace lo debilita).
También al bajar en un grupo la fuerza aumenta (y por tanto la temperatura de fusión) ya que los orbitales están separados menos energéticamente y se facilita la formación de enlaces.
Si se te dificultó esta parte También puedes ver la siguiente imagen
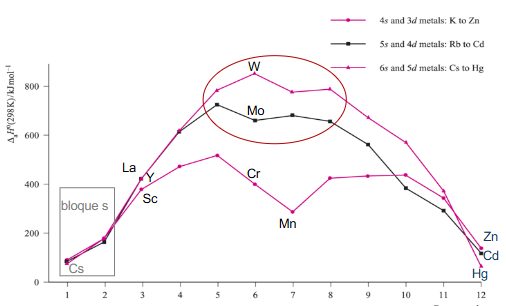
Pero esto no explica todo, que el mercurio sea líquido tiene que ver con 3 factores
Configuración electrónica:
Es el motivo que comente antes. Los átomos tienen electrones pero estos no se colocan de cualquier forma alrededor del núcleo, Cada uno se va colocando dentro de orbitales y en el caso del mercurio tiene los orbitales llenos. (Similar a lo que ocurre con los gases nobles). Esta es una configuración estable por lo que se resiste considerablemente a la liberación de un electrón, lo que dificulta la interacción con otros átomos.
Además al haber tantos muchos electrones se tienen que colocar en orbitales antienlazantes , estos reducen la fuerza del enlace porque tienden a separar los núcleos
Contracción de los lantánidos:
Si miras a la tabla periódica verás que en los metales de transición la segunda serie y la tercera tienen prácticamente el mismo tamaño, esto es debido a la contracción de los lantánidos. Esto es porque los electrones de los orbitales f no apantallan bien la carga nuclear, es decir que cada vez hay más protones y estos atraen con más fuerza a los electrones más externos. Reduciendo su núcleo. ¿En que afecta al mercurio?
Hace que el radio atómico del Hg sea más pequeño de lo esperado. El orbital 6s esté más cerca del núcleo, más compacto y menos disponible para el enlace
Para el Zinc y el Cadmio no existe un orbital F lleno por lo que no sufriría este efecto y vemos una temperatura de fusión notablemente mayor.
Aún con todo esto la temperatura de fusión para el mercurio sería baja, según cálculos teóricos rondaría los 66ºC, bastante baja y más hablando de un metal pero todavía sería un sólido
Efectos relativistas:
Me he dado cuenta que en ciencia en muchos temas diferentes siempre acabas recurriendo a Einstein y este es uno de esos casos. La última pista sobre el bajo punto de fusión del mercurio tiene que ver con la teoría de la relatividad. Es una teoría un tanto compleja pero para lo que nos interesa debes saber que la **masa de los objetos aumenta con la velocidad pero para que se note debe moverse a una fracción considerable de la velocidad de la luz, al aumentar su energía cinética aumenta y ese aumento de energía se ve reflejado en la masa.
En los elementos más pesados los electrones que los orbitan (y más mientras más cercano al núcleo) deben moverse muy deprisa para poder mantenerse en la órbita. Concretamente en el mercurio, los electrones más cercanos al núcleo deben alcanzar el 58% de la velocidad de la luz aumentando la masa de estos en un 23%. Los electrones más masivos son atraídos con mayor fuerza por el núcleo atómico, obligándolos a orbitar más cerca de lo normal. Es decir que además de la contracción de los lantanidos tiene una contracción relativista pero, esto exactamente en que influye, hay átomos más pequeños con puntos de fusión mucho mayor
Al tener las órbitas de los electrones tan contraídas se verán atraídos se verán muy atraídos por el núcleo. Tiene un gran número de protones. Pero mucho más hacia el núcleo de su propio átomo y no tanto hacia los electrones de sus átomos de mercurio vecinos, así que no pueden formar enlaces con ellos.
Por todo esto la energía de enlace será menor y por tanto la temperatura de fusión
