Técnicas de Extracción y Preconcentración: Apuntes Universitarios para Química Analítica
QUÍMICAAPUNTES
7/23/202511 min read

Extracción: separar algunas partes de las que se componen los cuerpos. Cogemos componentes de la muestra y lo sacamos de la matriz
Separación y Extracción: Transferencia de materia de una fase a otra. Extraer siempre implica separar, pero podemos separar en si un componente sin que implique una extracción
Pre-concentración: concentrar en un volumen reducido. cuando trazas de un analito se encuentran en una disolución en volumen grande.
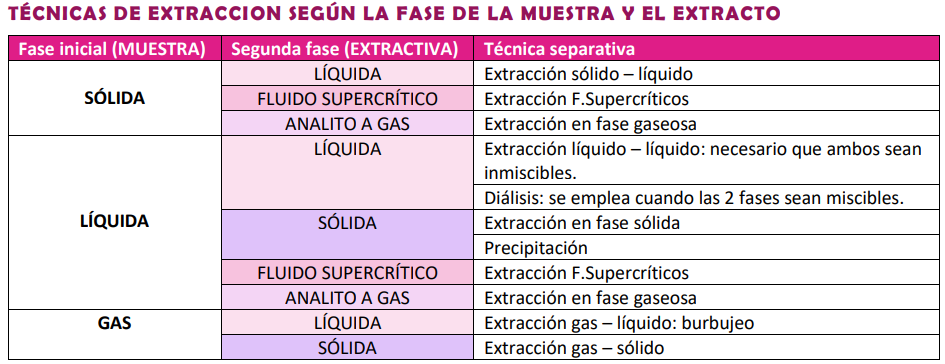
Técnicas de Separación y Pre-concentración
Usos:
Minimizar los efectos de matriz
Aplicar una instrumentación menos sofisticada
Facilitar análisis automatizados
Clasificación:
Continua o discontinua: Según la Dinámica operacional, eficacia separativa y modo de conexión al instrumento
Según la Naturaleza de la interfase en donde tiene lugar la transferencia de materia
Según Fuerzas implicadas en el proceso de transferencia de materia
Según Fundamento termodinámico o cinético, etc.
Extracción Sólido-Líquido
Lixiviación: Separación de analitos de una muestra sólida con una fase líquida a la que se transfieren los analitos. Una importante parte del sólido no desaparece, por ello no es disolución.
La duración y eficacia del proceso dependerá de:
Características de la muestra sólida: Superficie, propiedades físico‐químicas de la matriz. Una parte del sólido no va a desaparecer, esto dependerá de las características de la superficie sólida. Es por ello que si el analito es muy afín a la matriz va a ser complicado extraerlo.
Características físico‐químicas del soluto extraído: solubilidad en la matriz y en la fase extractiva. Nos interesa que la solubilidad de la fase extractiva sea mayor que la que haya en la matriz
Características físicas (Viscosidad y difusividad) y físico-químicas (polaridad) de la fase extractiva.
Condiciones experimentales de la operación: temperatura, presión, modos de poner en contacto las fases, tipo de energía, etc... Una P y T mayores favorecerán el paso del sólido al líquido ya que esto favorece la transferencia de materia.
Para especies inorgánicas usamos agua y para sustancias orgánicas, disolventes polares.
Si el proceso es lento, será necesario acelerarlo → Extracción acelerada, a mas T y P. Una mayor T favorece la solubilidad y difusividad y mayor P una mejor penetrabilidad y transporte. Aumentaremos la temperatura con calor o microondas y la presión con ultrasonidos o calor cerrado.
Podemos hacerlo de manera:
Discontinua: Aumentamos T con un sistema de calefacción. Colocamos un refrigerante en la zona superior.
Mixta: Común para extraer disolventes orgánicos muy apolares (grasas). El disolvente que vamos empleando en cada una de las etapas es puro y sin analito, cada vez se va reestableciendo el equilibrio de reparto. Lento
Continua: Una única etapa el disolvente va pasando de forma continua por el sólido un número de veces y luego por una válvula va al aparato de medida. Más eficaz para analitos muy volátiles.
Extracción con fluidos supercríticos
Este método presenta ventajas:
Reducción de los tiempos de extracción
Los disolventes de extracción no son tóxicos ni caros
Técnica muy versátil y sirve para compuestos termolábiles
Es fácil extraer los analitos del FS
Podemos hacer extracciones fraccionadas
Facilidad de automatización y acoplamiento con técnicas en línea
Se añade el analito y se bombea el FS. El fluido extrae selectivamente los analitos, dependiendo de sus características fisicoquímicas y condiciones del proceso
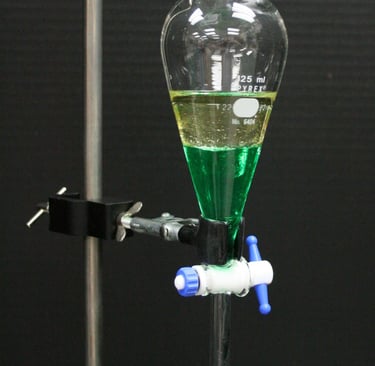
Extracción Líquido-Líquido
Se basa en el equilibrio de reparto de especies entre dos fases líquidas inmiscibles. Tenemos una fase acuosa y una fase orgánica
Agente extractivo: sustancia disuelta en la fase orgánica responsable de transferir el soluto
Modificador: sustancia disuelta que mejora la extracción, aumenta la solubilidad, etc...
Sistema de extracción: fase acuosa, fase orgánica y reactivos de ambas fases
Extracto: fase que contiene el analito después de terminada la extracción
Tipos de extracción líquido-líquido
Contracorriente: Permite la separación de mezclas complejas que tienen relaciones de distribución del mismo orden. Las dos fases implicadas se mueven en direcciones contrarias. Se usan tubos Craig
Simple: Cuando la extracción es muy favorable. Separamos una especie con un coeficiente de distribución elevado de otras próximo a 0.
Continua: Cuando la extracción no es favorable (D bajos), el volumen de muestra es grande o la cinética es lenta.

Extracción Líquido-Sólido
Se basa en la diferente afinidad de los analitos de la muestra (líquida o gaseosa) por una fase sólida. Lo importante es que la fase sólida sea adecuada, para que interaccione con el analito lo suficiente como para que quede retenido en el sólido. Luego realizamos una segunda etapa en la que recuperamos el analito pasándolo a otro disolvente. Los sólidos más empleados son:
Intercambio iónico: Resina sólida, sobre ese polímero se encuentran distintos grupos funcionales que son capaces de cambiar iones con la disolución, sirve para retener iones sobre la superficie del sólido, estos intercambiadores pueden ser aniónicos o catiónicos o una mezcla.
Puede fijar iones contenidos en la disolución que lo baña, intercambiándolos por otros de las mismas cargas que forman parte de la estructura del cambiador
Grado de entrecruzamiento (% DVB). A menor porcentaje tendrán menos grado de entrecruzamiento y la resina se hinchará mucho más
Granulometría. tamaño de grano: a menos mayas, más grande
Capacidad de intercambio (CE): Importante a nivel práctico. Número de mili-moles que puede tener un gramo de resina.
Pueden ser micro-reticulares, macro-reticulares o particulares.
La velocidad de intercambio depende de; coeficiente de actividad, tamaño del grano, agitación y concentración.
Apolar: nos sirve para compuestos apolares
Polar: Sílice, alúmina u otros óxidos inorgánicos con grupos polares que interaccionan con la muestra (habitualmente hidroxilo).
Gel: las partículas más pequeñas son las que se van quedando ralentizadas en su salida, se puede emplear para extraer moléculas que vamos a elegir, más grandes o más pequeñas en función del gel.
Anticuerpo: para extraer de forma selectiva una única molécula, el antígeno será el analito, y si fijamos el anticuerpo sobre el sólido podemos hacer que reaccione únicamente con el antígeno (analito).
Como hacer la extracción por intercambio iónico:
Columna (Dinámico): colocamos algo que impida el paso de la resina, la resina y la disolución que pasará en un flujo continuo, la disolución irá pasando. El que tiene más afinidad por la resina se queda retenido más tiempo
Se usa para Purificación de disolventes y reactivos, Separación de interferencias, Pre-concentración de trazas.
Extracción en fase sólida SPE
Se basa en la diferente afinidad de los analitos por la muestra (líquida o gaseosa) o por una fase sólida que puede ser de diferente naturaleza
Extracción de analitos en muestras líquidas: En lugar de poner el intercambiador en una columna de vidrio, es una columna de plástico con distintos tipos de sólidos en su interior. Sirve para extraer o limpiar
Extracción de analitos con el fin de extraerlos de la matriz o pre-concentrarlos. Pasamos un volumen inicial de la muestra con el analito y los interferentes. El sólido tiene que retener al analito y hacer que pase el interferente. Luego pasamos una disolvente que nos retire el analito del sólido.
Purificación de muestras líquidas en las que retenemos el interferente. El analito pasa por el sólido y el interferente se queda, en este caso a diferencia del anterior, NO PODEMOS PRECONCENTRAR, ya que el volumen de analito será el mismo que el de la muestra. Sirve para limpiar muestras.
CAPACIDAD DEL SORBENTE: Máxima cantidad de analito (o de interferentes) que puede ser retenida. Cuando todos los centros activos están ocupados, el soluto pasa sin ser retenido.
VOLUMEN DE RUPTURA: Volumen máximo de muestra que puede hacerse pasar por el disolvente sin que se pierda parte del analito. Cuando los centros activos están todos saturados y no retienen más.
Tipos de Sorbentes:
Apolares: Para compuestos orgánicos en muestras líquidas polares. Se eluye con un disolvente orgánico
Polar: Gel de sílice, alúmina… Sirve para extraer compuestos polares o purificar extractos orgánicos
De intercambio iónico aniónico: Para pre-concentrar compuestos orgánicos iónicos o fácilmente ionizables. Solo funcionarán si el pH>pKa. Tienen carácter ácido
De intercambio iónico catiónico: Para pre-concentrar compuestos orgánicos iónicos o fácilmente ionizables. Solo funcionarán si el pH<pKa. Tienen carácter básico
De Exclusión: Separa en función del tamaño molecular. Las moléculas grandes no pasan los poros y salen mientras las pequeñas entran y salen ralentizando su salida. Sirve para muestras biológicas.
De afinidad: Permiten extraer un compuesto o familia de compuestos de estructura similar
Cartuchos poliméricos: Son polímeros con diferentes grupos funcionales en su estructura que pueden actuar como sorbentes apolares, polares, de polaridad intermedia, intercambiadores de iones
Micro-Extracción en fase sólida MSPE
Usamos un sorbente sólido que va a tener una cantidad más pequeña que en la fase sólida. Se coloca en un dispositivo que contiene una aguja. Vamos a meter el sorbente dentro de la muestra y vamos a retener una cantidad proporcional a la de la muestra total.
Ventajas:
Disminuye el uso de disolventes tóxicos
Se puede aplicar a muestras sólidas
Etapas:
1- Extracción: metemos el sólido dentro de la muestra. Colocamos el dispositivo a través de un septum e introducimos un agitador magnético, después la aguja con el sorbente entra en la muestra. Una vez haya estado el tiempo necesario la aguja en contacto con la disolución, subimos el émbolo e introducimos la aguja dentro del dispositivo.
Influye la temperatura, tiempo de exposición, agitación y la fuerza iónica.
Aunque es principalmente una técnica de equilibrio de extracción, puede darse una extracción casi completa si el coeficiente de partición fibra‐muestra de analito es muy elevado. Hay fibras polares (para compuestos polares) y apolares (para apolares)
2- Desorción: Se puede hacer de 2 formas:
Directa: en el mínimo volumen de disolvente y con calentamiento suave. Igual que en la proceso de extracción pero en vez de colocar la muestra en el septum, se coloca en el disolvente.
Térmica: Volatilización por calentamiento e introducción directa en el inyector de una CG.
Sirve para:
Pesticidas
Fenoles
PHAs
Cafeína
Drogas
Extracción en Fase gaseosa
Cuando la presión de vapor de los analitos en la matriz es alta, su volatilidad permite utilizar técnicas en la que el reparto del analito se realiza entre una muestra sólida o líquida y una fase gaseosa
Espacio de cabeza estático: La muestra se coloca en un vial dejando un espacio (espacio de cabeza) suficiente entre la superficie de la misma y el septum. Se calienta para que los analitos pasen a fase gaseosa y con ayuda de una jeringuilla se toma una alícuota de la fase gaseosa
Espacio de Cabeza dinámico: Una corriente de gas inerte pasa por el espacio de cabeza arrastrando de forma continua los analitos. Estos son retenidos en un trampa criogénica o en un sorbente. Como se está moviendo continuamente, el sistema intentará alcanzar el equilibrio transfiriendo los analitos de forma continua desde la muestra a la fase gaseosa. Finalizada la extracción, los analitos retenidos son desorbidos. Podemos preconcentrar
Purga o Trampa: La diferencia con la extracción de la fase de cabeza es que en esta modalidad vamos a burbujear el gas inerte sobre la muestra. Se burbujea un gas inerte que arrastra los compuestos volátiles, mientras agitamos . Con un filtro de vidrio la corriente de gas es dividida en burbujas dentro de la muestra y retenemos los analitos. Se puede acoplar a un cromatógrafo de gases.
Destilación y evaporación de Disolventes
Destilación: Obtener el componente más volátil de una mezcla en la forma más pura posible. Obtención de un disolvente altamente purificado.
Evaporación: retener los componentes menos volátiles eliminando el componente más volátil.
Destilación al vacío: Una destilación simple o fraccionada pero con la ayuda de bajas presiones. Se consigue conectándolo a una bomba de vacío.
Tipos de Evaporación:
En recipiente abierto: Se deja el extracto en un recipiente abierto en campana hasta que se evapore
Con un gas inerte: Se pasa un flujo suave de un gas inerte sobre la superficie, calentándolo un poco
Evaporador-concentrador: Calentamos los componentes. Suben al refrigerante y se irán condensando, cayendo de nuevo a la muestra a la cual le hemos quitado parte del dte
Rotavapor:
Procesos de Membrana:
Filtración: Permite extraer componentes de forma más o menos selectiva en función del tamaño de los componentes y del disolvente.
Ósmosis: Permite extraer componentes de forma más o menos selectiva en función del tamaño de los componentes.
→ Ósmosis natural: Por igualdad de potencial químico de forma natural el dte pasará del lado donde menos concentrada este a donde más. Se crea un flujo por un gradiente de concentraciones. No sirve para preconcentrar
→ Ósmosis inversa: Aplicando una presión el disolvente pasará por la membrana pero los compuestos disueltos no. Nos permite obtener el disolvente puro y preconcentrar.
Se usa para purificar agua, disoluciones biológicas o preconcentrar volúmenes grandes
Diálisis: Nos permite separar solutos según su tamaño molecular gracias a su capacidad para difundir por los poros de una membrana semipermeable. La membrana permite el paso de partículas pequeñas e impide el paso a las grandes. El proceso está guiado por un gradiente de concentración.
Sirve para extraer analitos de bajo PM, extracción de drogas en fluidos biológicos o dasalinización de extractos de proteínas.
Pervaporación: Evaporación y difusión de un gas a través de una membrana no porosa. Las sustancias volátiles en la muestra calentada se evaporan difundiendo por la membrana y el vapor condensa en la superficie de una fase aceptora fría situada al otro lado de la membrana. Hay una diferencia de temperatura que impulsa al analito al otro lado de la membrana.
Sirve para eliminar de una pequeña cantidad de líquido en una mezcla, extraer compuestos orgánicos en aguas residuales y separar compuestos organometálicos. Coprecipitación: arrastre de una sustancia mediante fenómenos de adsorción, de oclusión o de sustitución de iones, por un precipitado de otra sustancia. Permite preconcentrar
Preconcentración electroquímica: Técnicas de redisolución
Preconcentración de un analito en la superficie de un electrodo. Preconcentramos el analito y luego medimos por voltamperometría.
Usamos C, Pt, Au o mercurio que son útiles porque retienen compuestos orgánicos por adsorción o inorgánicos por amalgamas. Las etapas ocurren sobre el mismo electrodo.
Preconcentración (acumulación): Se aplica un potencial que provoca la acumulación del analito en la superficie del electrodo (por reducción, oxidación o adsorción).
Redisolución (medida): Se cambia el potencial para oxidar o reducir el analito acumulado y se mide la corriente asociada a este proceso.
La intensidad de la corriente en la etapa de redisolución es proporcional a la concentración del analito en la muestra.
Voltamperometría de Redisolución Anódica:
Se emplea mucho para la determinación de metales pesados en concentraciones muy bajas ya que son muy tóxicos, como por ejemplo el Cd y Pb.
Preconcentración: Reducción: En un electrodo de mercurio, Se reduce el metal en solución (cationes metálicos) y se depone como metal neutro en el electrodo.
Las amalgamas se forman por según el electrodo de mercurio:
MFE: Una película muy delgada de mercurio sobre otro electrodo de grafito.
SMDE: Con gotas de mercurio estáticas y renovables que vertemos por un tornillo
HDME: Una gota de mercurio suspendida en la punta de un capilar, que permanece fija durante la medida
Reposo: mantenemos el mismo potencial pero no agitamos, Va disminuyendo la intensidad
Redisolución anódica: Oxidación: Se aplica un barrido anódico (potencial creciente), y el metal se oxida de nuevo a su forma iónica, generando una corriente. Vuelve a su forma de catión.
Voltamperometría de redisolución Potenciométrica:
En lugar de medir corriente, se mide el tiempo que tarda el analito acumulado en redisolverse a un potencial constante, y se relaciona con la concentración. Se acumula por deposición electroquímica, y luego se mide el tiempo durante el cual fluye una corriente hasta que el analito desaparece del electrodo.
Tras el periodo de preconcentración por reducción, los metales son oxidados químicamente y registramos la variación del potencial con el tiempo
Voltamperometría de redisolución catódica:
Preconcentración: Se oxida el analito y se reduce el electrodo de Hg a Hg2+ con una sustancia no electroactiva. Se formará un precipitado en dicha reacción que generará un potencial Eº1. Cambiará la intensidad dependiendo de la concentración de dicha disolución.
Redisolución: Se aplica un barrido catódico (potencial decreciente) para reducir y disolver el compuesto previamente formado.
Voltamperometría de redisolución adsortiva:
Preconcentración: El analito se adsorbe sobre la superficie del electrodo por agitación (sin necesidad de una reacción redox previa).
Redisolución: Se aplica un potencial para oxidar o reducir el analito adsorbido, generando una señal.
