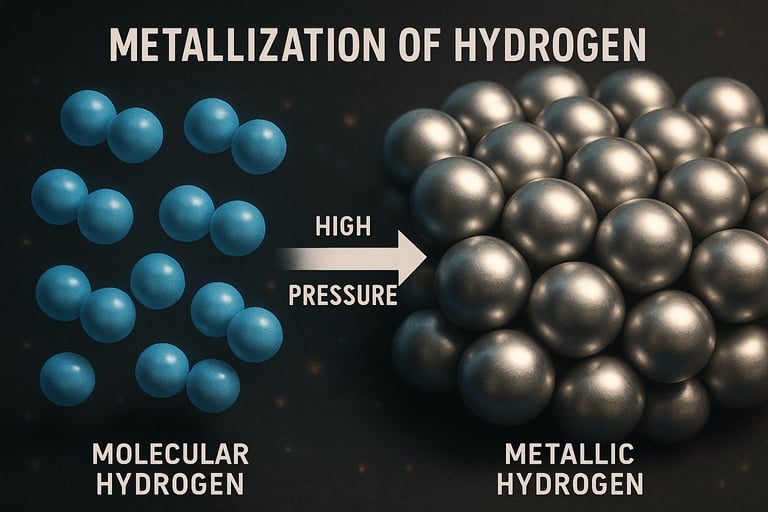
¿Cómo convertir cualquier cosa en un metal? Metalización por Presión
Has odio hablar del hidrógeno metálico u oxígeno metálico, esto es posible con la metalización por presión
QUÍMICAFÍSICA
8/8/20257 min read
Si vemos la tabla periódica podemos diferenciar tres grupos. Metales, no metales y semimetales. Bastante sencillo y fácil de diferenciar, quizás los semimetales nos de un poco más de problemas ya que tienen propiedades mixtas pero sería sencillo diferenciar un metal de un no metal. Nada tiene que ver el hierro, aluminio, titanio con hidrógeno, azufre, helio. Cuando respirar no tiene sentido pensar que el oxígeno que nos mantiene vivos es un metal. Bueno todo esto es correcto, efectivamente el oxígeno no es un metal pero con ayuda de la ciencia todos los elementos no metálicos podemos convertirlos en metálicos. No hablo de una mezcla como puede ser un óxido, hablo de un metal puro como lo es el hierro y esto es gracias a la Metalización por Presión.
Que es un Metal
La átomos se mantienen unidos por enlaces, los enlaces químicos y principalmente tenemos tres.
Enlace Iónico: Se produce por atracción electrostática entre iones que se atraen al tener cargas opuestas. Es un enlace no direccional, es decir la atracción se da en todas direcciones. Aquí encontramos las sales, cerámicas, etc
Enlace Covalente: Enlace que se produce por el solapamiento de orbitales. Los orbitales se solapan y se comparten los electrones entre los átomos. Como los orbitales tienen una geometría dada vamos a tener un enlace direccional. Aquí encontramos polímeros, el oxígeno, nitrógeno, compuestos orgánicos, etc
Enlace Metálico: Como bien dice sucede en metales. En este tenemos los átomos de los metales en forma de catión (carga positiva) rodeado por los electrones de valencia deslocalizados. Como si se tratase de una nube o un mar de electrones que los rodea y los mantiene unidos.
Gracias a esto los electrones tienen buena movilidad a través de todo el material y una carga que se mueve es igual a corriente eléctrica. Por esto los metales son buenos conductores de calor y electricidad.
Como la deslocalización de produce en todas direcciones es un enlace no direccional, no tiene una forma definida y eso le da buena ductilidad, el mar de electrones solo tiene que adaptarse a la nueva forma
En el enlace metálico los electrones se comparten entre todos los átomos en todas direcciones pero en el covalente se comparten electrones entre aquellos que se solapan
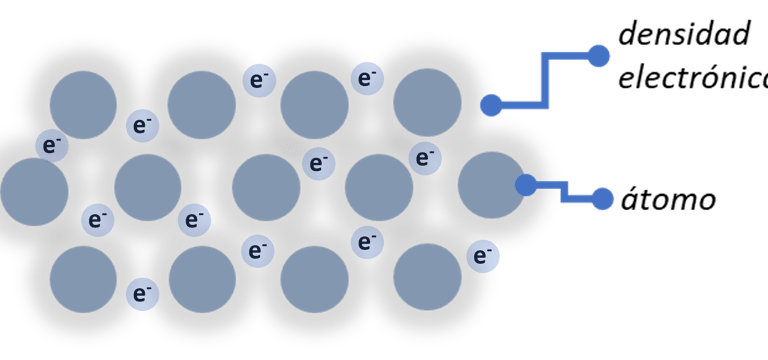


Después hay otros enlaces de menor intensidad que son los enlaces intermoleculares. Las fuerzas de Van Der Waals, puente de hidrógeno, puentes de halógenos o las interacciones o-hole, pero no serán muy importantes aquí.
Algo se considera un metal si presenta conductividad a 0 kelvin. Luego también presenta otras propiedades como su brillo, maleabilidad o ductilidad. Otras propiedades como las temperaturas de fusión y ebullición, dureza o estados de oxidación variarán según son metales del bloque S,P,D o F. En los no metales los electrones están atrapados en enlaces o en pares no compartidos y como norma general no conducen la electricidad
Metalización por Presión: Volverlos metales
Si pudiésemos forzar a los átomos a compartir sus electrones con todos sus vecinos no habría tanta diferencia entre un enlace metálico y uno covalente. Esto se puede hacer comprimiéndolo gracias a la presión. Al presionar el material, las distancias entre los átomos disminuyen. Esto provoca que Las órbitas electrónicas empiecen a solaparse más, Los electrones empiecen a deslocalizarse, o sea, dejan de pertenecer a un solo átomo.
A medida que aumenta la presión los átomos se comprimen, reduciéndose drásticamente las distancias interatómicas. Esto provoca un mayor solapamiento de orbitales atómicos la presión extrema disocia las moléculas y transforma enlaces covalentes en redes metálicas con enlaces metálicos característicos, donde los electrones ya no están ligados sino compartidos colectivamente. Aunque sea en un no metal
Por supuesto empieza a tener características de un metal. Los electrones de valencia dejan de estar ligados a átomos específicos o enlaces focales, y pasan a comportarse como un gas de electrones itinerantes (estado metálico). Viéndolo desde la teoría de bandas, las bandas electrónicas se ensanchan y la brecha de energía (band gap) entre bandas de valencia y conducción se cierra o se solapa. Por lo que, cuando antes se necesitaba mucha energía para liberar los electrones de un enlace covalente, ahora la energía es casi 0.
Para verlo mejor con un ejemplo imaginemos una molécula de yodo I-I unidos por un simple enlace. Si medimos la distancia de enlace, una forma de ver la fuerza de ese enlace vemos que es mayor que la esperada, es decir, es más débil de lo calculado teóricamente. ¿Cuál es la causa de esto?
Las moléculas de Yodo, I2, comparten densidad electrónica entre sí. De manera débil, no con la misma intensidad que se compartiría en un metal pero si hay una pequeña contribución que hace que no sea necesario compartir tanto los electrones dentro de la molécula. Esto es ya a presión atmosférica, si veis yodo sólido vemos brillo metálico, aunque no tenga las demás propiedades de un metal.
Pero como he dicho esto podemos forzarlo aún más, con la ayuda de la presión podemos acercar tanto los átomos que todos acaben interactuando y compartiendo densidad electrónica. El comportamiento de los electrones cambia de localizados dentro del enlace a deslocalizados por toda la estructura. Esto en el yodo sucede a 0,16 MegaBares o 16000 atmosferas. Ahora si, se vuelve un conductor de la electricidad.
En teoría, cualquier elemento puede volverse metálico si lo comprimes lo suficiente y controlas la temperatura. Incluso puede convertirse en un superconductor. Pero no son estables, una vez retirada la presión vuelven a su forma normal
Hidrógeno Metálico
Es el más famoso de todos, la metalización del hidrógeno a alta presión, junto con la transición molecular-atómica asociada, es uno de los problemas más importantes en el campo de la física de alta presión. Incluso se le ha definido como el santo grial de la física de altas presiones.
Es importante porque se cree que en el interior de planetas gaseosos (que son ricos en hidrógeno) como Júpiter, Saturno, Urano o Neptuno donde las presiones son enormes, exista un gran núcleo de hidrógeno metálico.
Aquí en la tierra se intenta fabricar pero todavía sin excito. En 2017, un grupo de Harvard anunció que habían observado hidrógeno metálico usando una celda de yunque de diamante. Pero el resultado fue controvertido y otros grupos no han podido replicarlo. Hasta ahora nadie ha podido reproducir de forma inequívoca ese resultado, así que la comunidad científica no lo acepta aún como confirmado.
Se cree que sean necesarios entre 4 y 5 Megabares, una autentica locura ya que sería alrededor de 4 y 5 millones de atmosferas.
Oxígeno Metálico
El ejemplo que puse al inicio y lo puse por algo ya que en este caso si se ha logrado. Fueron necesarios 0,96MBar (960.000 atmosferas). la estructura ε antiferromagnética colapsa magnéticamente aparece una fase ζ metálica que es superconductora.
En este caso se puede mostrar una foto ya que no es como lo conocemos o como si lo enfriásemos hasta un sólido. Cuando un elemento no metálico se vuelve metálico, empieza a mostrar brillo metálico Esto ocurre porque: Los electrones libres reflejan la luz visible. Pero estamos hablando de muestras microscópicas encerradas entre dos puntas de diamante a centenas de GPa (solo podemos conseguir tales presiones en celdas de yunques de diamante) y en muchas veces también a temperaturas criogénicas. Por lo que no es sencillo obtener una imagen visual. En este caso el oxígeno e vuelve opaco y luego metálico, pero no es tan brillante como un metal puro. Pero como dije antes, no son estables así que al retirar la presión vuelve a su forma normal. Por cierto el oxígeno es del centro.
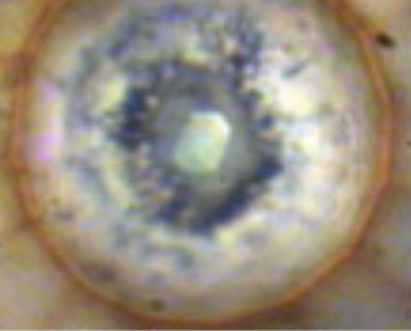
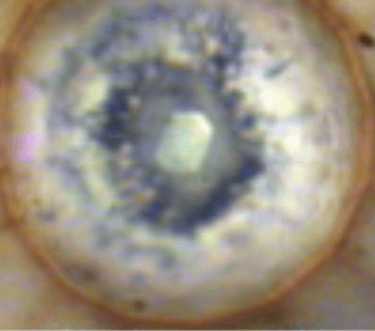
Otros elementos metálicos
Neón Metálico:
Se predice que tiene la presión de metalización más alta 2084 MBares (2.084.000.000 atmosferas, una auténtica locura). Pero bastante interesante, se trata del quinto elemento más abundante en el universo, y está presente en muchos planetas y estrellas, como Saturno y Júpiter y su comportamiento de transición de aislante a metal también es vital para construir la estructura interna de estos objetos.
Carbono Metálico:
Bueno sabemos que al someter a carbono a mucha presión su forma más estable es la de diamante un gran aislante. Si seguimos con la presión encontramos una nueva fase que se cree que aparezca a los 10Mbares conocida como Carbono B8. Sin embargo, en condiciones extremas, los límites de fase y las propiedades de fusión del carbono elemental son poco conocidos, y sus propiedades electrónicas no se comprenden bien pero se cree que pueda tener carácter metálico e incluso ser superconductor. Estas transiciones aún no se han investigado experimentalmente, porque la presión máxima alcanzada hasta ahora en experimentos con celdas de yunque de diamante sobre carbono es de 1,40 MBar.
Fósforo Negro:
Unos de los alótropos del fosforo. A medida que la tensión aumenta, la banda prohibida directa original del fósforo negro se transforma en una banda prohibida indirecta y, finalmente, muestra la banda prohibida cero de un metal.
Arsénico
El arsénico me pareció un caso curioso. Resulta que tiene 3 alótropos conocidos, el arsénico gris, amarillo y negro.
El arsénico gris, también llamado arsénico metálico, como bien dice tiene propiedades metálicas como ser un buen conductor. su estructura es como el fosforo negro (son del mismo grupo comparten propiedades el arsénico y fosforo).
El arsénico amarillo es lo contrario, se comporta como un no metal. En este caso puede tener propiedades de metal como de no metal en condiciones normales solo con cambiar la estructura. El arsénico amarillo tiene una estructura igual al fósforo blanco, un tetraedro.
El arsénico negro es difícil de obtener por lo que no se sabe mucho de sus propiedades, pero se cree que metalice a 0,022MBar.